O que são astrocitomas?
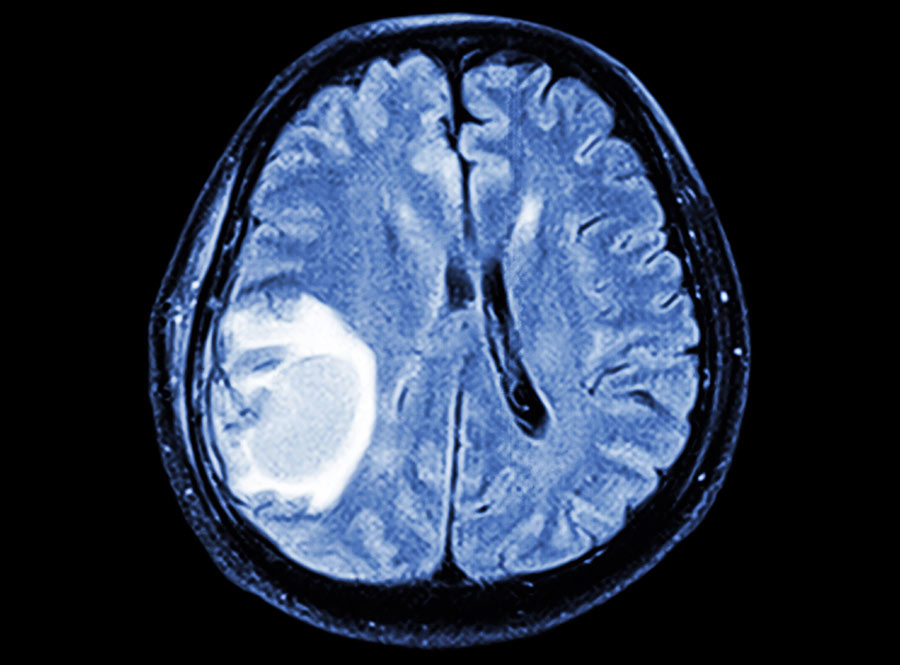
Os astrocitomas são um tipo de glioma, ou seja, tumores primários que se originam no próprio Sistema Nervoso Central (SNC). Esses tumores surgem a partir dos astrócitos, células que fazem parte do tecido de sustentação e proteção do cérebro.
Os astrocitomas podem ser classificados em dois grandes grupos:
- Astrocitomas circunscritos: como o astrocitoma pilocítico, geralmente de baixo grau e bem delimitado (discutido previamente).
- Astrocitomas difusos: são infiltrativos, ou seja, misturam-se ao tecido cerebral normal. Este é o foco do nosso texto de hoje.
Como classificar os astrocitomas difusos IDH-mutados
Nos últimos anos, o avanço das análises genéticas e moleculares permitiu uma melhor classificação desses tumores. Um dos marcadores mais importantes é a presença da mutação no gene IDH (isocitrato desidrogenase).
Os astrocitomas difusos IDH-mutados:
- Apresentam mutação no IDH (pesquisada por imuno-histoquímica, PCR ou sequenciamente genético).
- Não possuem a codeleção dos cromossomos 1p/19q, o que os diferencia dos oligodendrogliomas.
- São classificados pela Organização Mundial da Saúde (OMS) em:
- Grau 2 (baixo grau)
- Grau 3 (anaplásico, alto grau)
- Grau 4 (alto grau; antigamente denominado glioblastoma e atualmente denominado: astrocitoma IDH mutado, grau 4)
Faixa etária e localização
Esses tumores são mais frequentes em adultos jovens e de meia-idade, com discreta predominância no sexo masculino. As localizações mais comuns incluem os lobos frontal e temporal, mas podem surgir em qualquer região do cérebro.
Por que a análise genética/molecular é importante?
A identificação da mutação no IDH e de outros marcadores moleculares é essencial para definir o tipo de tumor, estabelecer o prognóstico, guiar as estratégias de tratamento e avaliar a possibilidade de terapias-alvo específicas.
Tumores IDH-mutados, de forma geral, apresentam melhor prognóstico em comparação com aqueles sem essa mutação (IDH selvagem).
Quais os sinais e sintomas?
Alguns pacientes podem estar assintomáticos, sendo o glioma um achado incidental em exames de imagem. Quando presentes, os sintomas variam conforme a localização e o tamanho do tumor, podendo incluir:
- Crises epilépticas (o principal sintoma e muitas vezes o primeiro a se manifestar)
- Dores de cabeça
- Déficits neurológicos (fraqueza, dificuldade de fala, alterações visuais)
- Alterações comportamentais ou cognitivas
Como é o tratamento?
O tratamento é individualizado, levando em conta a localização e a extensão da lesão, idade, estado clínico do paciente e perfil molecular (para tratamentos adjuvantes – após a cirurgia). As opções incluem:
- Cirurgia: Realizada com o objetivo de remoção máxima e segura do tumor. A extensão da ressecção é um dos principais fatores prognósticos.
- Radioterapia
Indicada em situações específicas após a cirurgia, especialmente após a cirurgia incompleta (ressecção subtotal), tumores de alto grau e pacientes de maior risco. Essa decisão é complexa e deve ser tomada após discussão multidisciplinar. - Quimioterapia
Assim como a radioterapia, é indicada em situações específicas após a cirurgia. Pode ser via oral ou endovenosa. - Terapias-alvo
Com os avanços no conhecimento molecular, surgiram opções terapêuticas direcionadas contra a mutação IDH, como o Vorasidenib — recentemente aprovado pelo FDA (agência regulatória dos Estados Unidos). Além disso, estudos clínicos com outros inibidores de IDH estão em andamento. Os resultados preliminares são promissores, e há grande expectativa para que essas terapias estejam disponíveis em nosso arsenal clínico em breve.
Quais as ferramentas auxiliares na cirurgia?
A neurocirurgia oncológica moderna conta com recursos que aumentam a segurança e eficácia do procedimento, como:
- Neuronavegação: auxilia na localização lesional.
- Monitorização neurofisiológica intraoperatória: preserva funções motoras e de linguagem.
- Cirurgia com paciente acordado (awake surgery): permite testar funções cerebrais durante a ressecção, especialmente relacionadas a linguagem.
- Ultrassom intraoperatório: avalia a extensão da ressecção em tempo real.
- Ressonância magnética intraoperatória: auxilia na avaliação da extensão da ressecção cirúrgica, permitindo, se necessário, o retorno imediato à sala cirúrgica para ressecções adicionais.
Qual o prognóstico?
O prognóstico depende de fatores como: grau do tumor, idade do paciente, extensão da ressecção cirúrgica, perfil molecular.
De forma geral:
- Tumores IDH-mutados tendem a ter uma sobrevida maior e um curso mais lento.
- Mesmo após o tratamento inicial, há risco de recorrência.
- O acompanhamento deve ser contínuo e multidisciplinar, envolvendo neurocirurgião, oncologista, radio-oncologista e equipe de suporte.
Devo tratar um astrocitoma difuso, provável por imagem, diagnosticado incidentalmente em paciente assintomático?
A resposta é sim. Estudos demonstram que, mesmo em casos assintomáticos, os pacientes se beneficiam de uma ressecção precoce e segura, considerando o impacto positivo na sobrevida global e no controle da progressão tumoral